ラーニングコーナー
2019/06/17
ヒト腸管オルガノイドの樹立および維持培養プロトコール
- 用途別細胞培養
「オルガノイド研究ハンドブック」では、腸管・脳・膵臓・肝臓・腎臓・肺オルガノイドの培養プロトコル、アプリケーション、文献、FAQなどを紹介しています。
IntestiCultTM Organoid Growth Medium (Human) は、ヒト腸陰窩由来の腸オルガノイドを効率的に樹立し維持するために最適化された、細胞培養用の完全培地です。
ヒト用IntestiCult 製品説明
腸上皮研究のために、腸オルガノイドはin vitroの簡便な器官型培養システムを提供します。腸オルガノイドは成体腸上皮における既知の細胞種を含んだ極性のある上皮細胞層によって囲まれた、機能的な管腔を有します。成熟腸オルガノイドには、in vivoの腸陰窩に類似した芽状の突起が形成されます。腸オルガノイドのアプリケーションには、腸上皮の発生・機能の研究、腸の疾患モデリング、標的低分子スクリーニングが含まれ、さらに成体幹細胞の機能の検証や再生医療にも利用することができます。
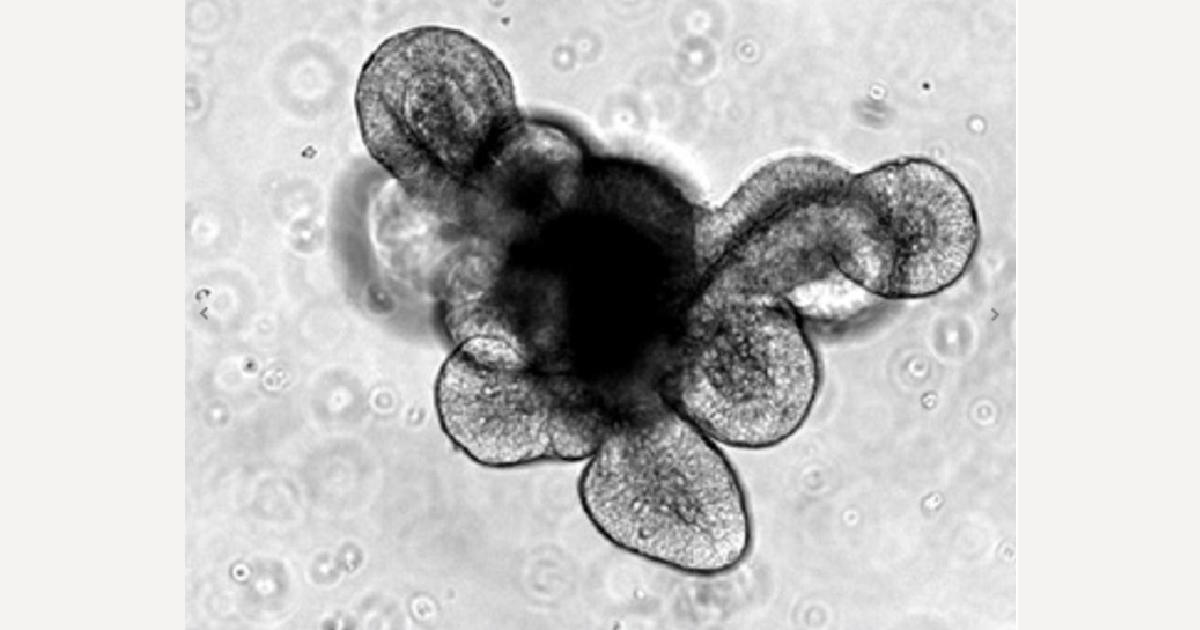
IntestiCult Organoid Growth Medium (Human) を用いて培養することで、ヒト腸管オルガノイドの迅速で安定した樹立と維持が可能になります。下図は、ヒト結腸生検サンプルから分離した初代オルガノイドを培養した様子です。
詳しくは、以下よりご覧ください。
IntestiCult:「7日以内で」3次元モデルのヒト腸管オルガノイドを形成・維持用培地
試薬の調製
A. IntestiCultTM Organoid Growth Medium (Human) 完全培地の調製
Complete IntestiCultTM Organoid Growth Medium (Component A + Component B。以下、完全培地)を作製する際には、無菌操作で行ってください。
下記は100 mL の完全培地を調製する場合の例です。異なる容量を調製する場合には、容量に応じて調製してください。
- Component AとComponent Bを室温(15 - 25°C)または2 - 8°Cで一晩解凍し、よく撹拌して下さい。
注:解凍した後は、直ちに使用するか、分注して-20℃で保存してください(保存は3か月まで可能です)。分注して保存した試薬を解凍した後は直ちに使用し、再凍結はしないでください。 - 50 mLのComponent Bを50 mLのComponent Aに添加し(これにより完全培地となります)、よく撹拌してください。
注:すぐに使用しない場合、完全培地は2-8℃で1週間まで保存可能です。 - 必要な抗生物質を使用する直前に完全培地に添加します。(例:50 μg/mL gentamicinや100 units [100 μg/mL] penicillin/streptomycinなど)
B. DMEM + 1% BSA の調製
DMEM + 1% BSAを調製する場合には無菌操作で行ってください。
下記は50 mL のDMEM + 1% BSAを調製する場合の例です。異なる容量を調製する場合には、容量に応じて調製してください。
- 50 mLサイズのコニカルチューブ中で、 2 mLの25% BSAを48 mLのDMEM/F-12(15 mM HEPES入り)に添加します。
- チューブを反転させてよく撹拌し、氷上に静置します。
注:すぐに使用しない場合は、2 - 8°Cで6ヶ月まで保存可能です。
ヒト腸オルガノイド培養のプロトコール
実験開始前にプロトコール全体を確認してください。下記プロトコールを実施する際は、無菌操作で行ってください。
A. 生検からのヒト腸陰窩単離
- 100 μLのMatrigel®を氷上で解凍します。
注:これは4つの培養ドームを作製するための十分量です。陰窩の数によって(セクションBのステップ 1を参照)、必要なMatrigel®の量は異なります。 - 次の試薬を氷上に静置します:D-PBS (Ca++ 及び Mg++を含まない) 、DMEM + 1% BSA (「試薬の調製」セクションBを参照)
- 細胞培養用24ウェルプレート(tissue culture treated)を37°Cのインキュベーター内で最低2時間温めます。
- 15 mLコニカルチューブ中で、組織サンプルを10 mLの氷冷PBSで洗浄します。組織は重力によって沈降させ(~5秒)、上清を吸引します。
- ステップ4を再度行い、チューブ内の上清を1 mL残します。
- 1 mLピペッターを用いて、組織及び残っている上清を5 mLマイクロ遠心チューブに移します。
- 無菌ハサミを用いて、組織が5 mm以下の断片になるよう、よく切り刻みます。組織断片は、1 mLピペッターを用いて新しい15 mLコニカルチューブに移します。マイクロ遠心チューブをPBSでリンスし、そのリンス液を組織断片に添加します。
- 組織断片は重力によって沈降させ(~5秒)、上清を吸引します。
- 10 mL の Gentle Cell Dissociation Reagent (GCDR) を添加します。中程度のスピード(~40 rpm)のシェーカー上で振盪しながら氷上で30分間インキュベートします。
- 290 x g で5分間遠心し、上清を吸引します。
注(プロトコールのリマインダーとして):ピペットチップは組織サンプルを取り扱う前に予めDMEM + 1% BSAでリンスしておいてください。これにより、陰窩がピペットチップの壁に粘着するのを防止する事ができます。 - 1 mLの氷冷DMEM + 1% BSA.を添加します。陰窩を組織から剥離するため、1 mLピペッターを用いて、20回しっかりとピペッティングを行ってください。
注:ピペットチップがチューブの壁や底に触れないようにしてください。 - 1 mLピペッターを用い、チューブの内容物を、内容物がある側に傾けたセルストレーナー(メッシュサイズ70 μm)に通し、新しい15 mLコニカルチューブに回収します。内容物が入っていたチューブを1 mLのDMEM + 1% BSAでリンスし、その液もセルストレーナーを通してコニカルチューブに回収します。オルガノイド培養をする場合にはセクションBに進んでください。
B. 単離したヒト結腸陰窩からのオルガノイド培養
- 次のようにサンプル(セクションAで単離したもの)における陰窩の総数を決定します。
a. サンプルを10 μLずつ取り (Aliquot)、計測盤(例:スライドグラスや6-wellプレートのウェルなど)にアプライします。このようなものを3つ作製します。
b. 倒立顕微鏡を用いて、各Aliquot中の陰窩の数を計測します。
c. 3つのAliquotでのカウントから平均値を計算し、その値に200を掛けることによりサンプル2 mL中の陰窩の総数を算出します。
d. ドーム1つあたり陰窩が1000個として、何個の培養ドームを播種することが可能か決定します。
例(Aliquotのカウントから陰窩の総数を算出):
注:培養ドームあたりの陰窩を1000個とすることにより、150-200個の成熟オルガノイドを作製することができます。
Aliquot 1: 18個
Aliquot 2: 23個
Aliquot 3: 19個
20個(Aliquot 1-3の平均)x 200 = 4000個(陰窩の総数)
これは、1000個の陰窩を含む培養ドームを4つ作製するのに十分な量です。 - サンプルを200 x gで5分間遠心し、上清100 μLを残して吸引します。
注:下記は、1000個の陰窩を含む50 μLの培養ドーム4個に対応した作業ステップです。これよりも少ない、または多い数の培養ドーム用には、培養ドームの容量と容積比が1 : 1となるようにMatrigel®とDMEM + 1% BSAの合計容量を調節してください。(例:50 μLの培養ドーム8個の場合は、下記のステップ4でMatrigel®200 μLとDMEM + 1% BSA100 μLを加えてください。) - 24ウェルプレートを37°Cインキュベーターから出します。200 μLピペットチップをDMEM + 1% BSAでピペッティングして予め湿らせておきます。
- 100 μLのMatrigel®をサンプルチューブに入れます。10回上下にピペッティングしてペレットをしっかりと再懸濁します。泡を入れないように行います。
- 予め湿らせておいた200 μL ピペットチップを用いて、Matrigel®と陰窩の懸濁液50 μLを吸い上げ、次のように細胞培養用24ウェルプレート(tissue culture-treated)の中央にある8個のウェルのうちの1つに添加します:
a. ピペットをウェル中央に対して垂直に持ちます。ピペットチップをウェルの底につけないように近づけます。
b. ピペットチップの先端に液滴が見えるようになるまでピペットのピストンを少し押し下げます。
c. 液滴がウェルの底に触れるまでゆっくりとピペットを下に下げます。
d. ピペットをウェルから離して持ち上げる際、ピペットの中に残っている液を穏やかに押し出します(押し出しはピペットのピストンが最初に止まる所までにしてください)。
注:Matrigel®と陰窩の懸濁液は、氷上から離した後60秒以内に播種するよう素早く行ってください。 - Matrigel®と陰窩の懸濁液を全て処理するまでステップ5を繰り返します。
- 注意してプレートを37°Cインキュベーターへ移します。ドームが固まるよう37°Cで10分間インキュベートします。ドームを壊さないようにしてください。
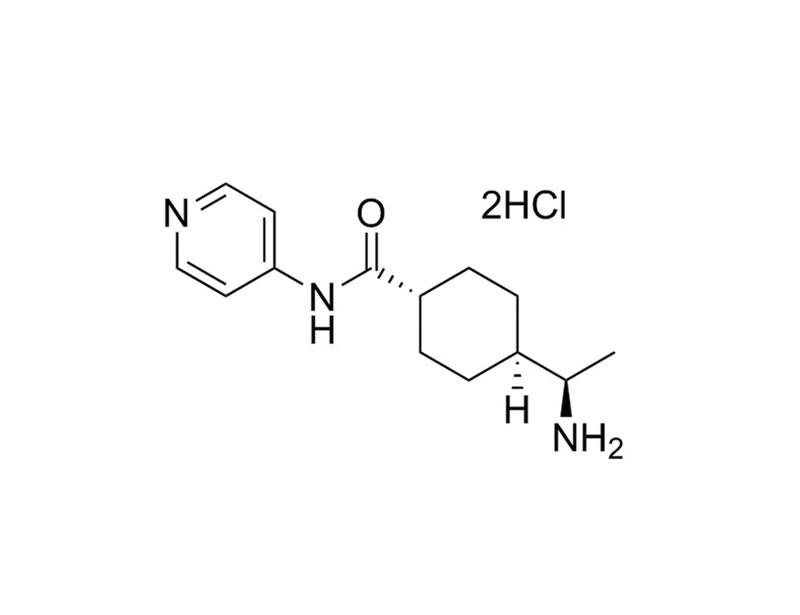
- 室温 (15 - 25°C) で3 mLのIntestiCultTM Organoid Growth Mediumを調整します (「試薬の調製」セクションAを参照)。初代培養の場合(まだ継代したことがないオルガノイドの場合)は、10 μL の3 mM Y-27632を添加し(終濃度10 μM)、よく混合してください。
注:各培養ドームには750 μLのIntestiCultTM Organoid Growth Mediumが必要です。3 mLの培地で4つの培養ドームを処理することができます。異なる数の培養ドームを取り扱う場合には、培地の量をそれに応じて調整してください。 - 750 μLのIntestiCultTM Organoid Growth Medium(初代培養の場合はY-27632入り)を各ウェルにピペッティングにて添加します。ピペッティングは穏やかに、ウェルの壁から培地を落とすように行います。ドームの上から培地を落とさないようにしてください。
- 使用しなかったウェルに無菌PBSを添加します。
- 培養プレートに蓋をのせ、37°C、 5% CO2でインキュベートします。
- 2日毎に、IntestiCultTM Organoid Growth Medium (Y-27632は必要ありません)を全量培地交換します。
- 継代の際はセクションCへ進みます。
C. ヒト腸オルガノイドの継代
初代培養の場合は、7-14日後に行います。過去に継代をしているオルガノイドの場合には、7−10日毎に継代を行います。嚢胞性、または出芽の見られる大きめのオルガノイドからは、小さめであったり、または暗く見えたり崩壊している、または過剰に出芽したオルガノイドよりも成長可能な断片を多く得ることができます。
- 24ウェル細胞培養用プレート(tissue culture-treated)を37°Cのインキュベーターで2時間以上インキュベートして温めます。
- IntestiCultTM Organoid Growth Medium (Human)を調整し、室温(15 - 25°C)まで温めます。
注:継代には、各ウェルあたり750 μLの培地が必要です。 - Matrigel®を氷上で解凍します。使用する各ウェルあたり25 μLが必要となります。
- DMEM + 1% BSAを氷上に静置します。
- 継代するウェルのMatrigel®ドームを崩さないよう、注意深く培地を取り除いて廃棄します。
- 1 mL の室温(15 - 25°C)のGCDRを、各ウェル内の露出したドームの頂上に添加します。室温で1分間インキュベートします。
- 1 mLピペットチップを予めGCDRでピペッティングして湿らせておきます。このピペットチップを使ってウェルの底からMatrigel®ドームをしっかりと剥がし取ります。ウェル内でGCDRを上下に2−3回ピペッティングして、ドームとオルガノイドを離散させます。確実に全てのMatrigel®の断片がプレートの底から離れ、リンスされるようにしてください。
注:上下にピペッティングする際、ピペットチップがウェルの底につかないようにしてください。 - 同じピペットチップを使って、オルガノイド混合物を15 mLコニカルチューブに移します。
- 新しく空になったウェルに、1 mLのGCDRを添加します。GCDRで予め湿らせたピペットチップを使って、GCDRを2 − 3回上下にピペッティングすることでウェルをリンスします。ウェルの中にある内容物はステップ8で用いた15 mLのコニカルチューブに回収します。
- 継代するウェルそれぞれについて、ステップ7-9を繰り返し行います。
- 中程度のスピード(~40 rpm)のシェーカー上で振盪しながら室温(15 - 25°C)、10分間インキュベートします。
- チューブは290 x g で5分間、2 - 8°Cで遠心し、上清を穏やかに取り除いて廃棄します。
- 各チューブに1 mLの氷冷したDMEM + 1% BSAを添加します。予め湿らせておいた1 mLピペットチップを使って、上下に15回しっかりとピペッティングを行い、オルガノイドを再懸濁します。
注:ピペットチップはウェルの壁や底に触れないようにしてください。 - 1 mLのピペッターを用いて、チューブの内容物を、内容物がある側に傾けてセルストレーナー(メッシュサイズ70 μm)に通し、新しい15 mLコニカルチューブに回収します。内容物が入っていたチューブを1 mLのDMEM + 1% BSAでリンスし、その液もセルストレーナーを通してコニカルチューブに回収します。
この後の継代プロトコールのステップについては、セクションBを参照してください。
操作の注意事項
- オルガノイドを完全に破壊すると、IntestiCultTM Organoid Growth Medium中で成長可能な単細胞培養となりますが、成熟するまでにより長い時間を必要とします。単細胞由来のオルガノイドは主に嚢胞状の形態になります。
- Matrigel®は温度に敏感であり、室温では数分以内に重合します。Matrigel®は氷上に置き、プレーティングの前に重合しないようにしてください。
必要な製品 リスト
キット構成
下記はキット(製品コード:ST-06010)として販売しています。個々の構成品の単品販売はしておりません。
| 商品コード | 商品名 | 構成品内容 | 梱包単位 | 保存温度 | 輸送温度 |
| ST-06010 | IntestiCultTM Organoid Growth Medium (Human) |
IntestiCultTM Organoid Growth Medium Human Component A* | 50 mL | 冷凍(-20℃) | 超冷凍(-80℃) |
| IntestiCultTM Organoid Growth Medium Human Component B | 50 mL | 冷凍(-20℃) | 超冷凍(-80℃) |
* ヒト血清由来成分を含有します。ドナーは検査により事前にHIV-1/2、hepatitis B、hepatitis C陰性であることを確認していまが、潜在的に感染性があるものとして取り扱ってください。
キットに含まれない試薬
- DMEM/F-12 with 15 mM HEPES (ST-36254)
- 25% Bovine serum albumin (BSA) in phosphate-buffered saline (PBS)
- Corning® Matrigel® Matrix, Growth Factor Reduced (GFR), Phenol Red-Free (Corning 356231)
- D-PBS (Without Ca++ and Mg++) (ST-37350)
- Gentle Cell Dissociation Reagent (ST-07174)
- Costar® 24 Well Flat-Bottom Plate, Tissue Culture-Treated (ST-38017)
- Falcon® 70 μm Cell Strainer (Corning 352350)
- Y-27632 (ST-72302)
関連情報
IntestiCult:「7日以内で」3次元モデルのヒト腸管オルガノイドを形成・維持用培地
IntestiCult Organoid Growth Medium (Human) 製品マニュアル(英語)
IntestiCult Organoid Growth Medium (Human) 製品フライヤー(英語)
腸管・大脳・肝臓・膵臓・肺・腎臓オルガノイド研究用培地(STEMCELL Technologies社)
ザ・「オルガノイド」 - 革新的な3次元培養で作製された"ミニ臓器"
オルガノイドの勉強コーナー(E-Learning:毒性試験・3D疾患モデルなど)
「IntestiCult Training」腸管オルガノイド培養をSTEMCELL Technologies社の研究者に学ぶ!
ヒトES/iPS細胞から長期培養可能な「ミニ腸」オルガノイドを効率的に!