注目の製品情報
2023/07/10
「mTeSR Plus-cGMP」:週2回の培地交換で高品質なES/iPS細胞を!
- 用途別細胞培養
「mTeSR™ Plus-cGMP」は、週2回の培地交換でも高品質な細胞を維持できるように、緩衝作用(pH)の改善とFGF2の安定化を実現したヒト多能性幹細胞(ES/iPS細胞、hPSC)の維持培養用培地です。
ここでは、「mTeSR™ Plus-cGMP」で維持したES/iPS細胞の品質がどのように優れているのかをご紹介します。
フレキシブルな培地交換スケジュール
mTeSR™ Plusは、週2回の培地交換でもヒト多能性幹細胞を高品質に維持することができます。(パフォーマンステスト済み)
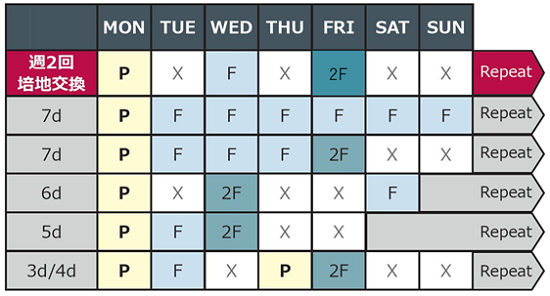
週2回の培地交換スケジュール例
P = Passage, F = Single Feed, 2F = Double Feed
mTeSR™ Plus培地交換のルールに従って、各自のフレキシブルな培養スケジュールで実施してください。
使用方法の詳細は、製品添付文書を参照
高品質な細胞① pH緩衝作用の向上
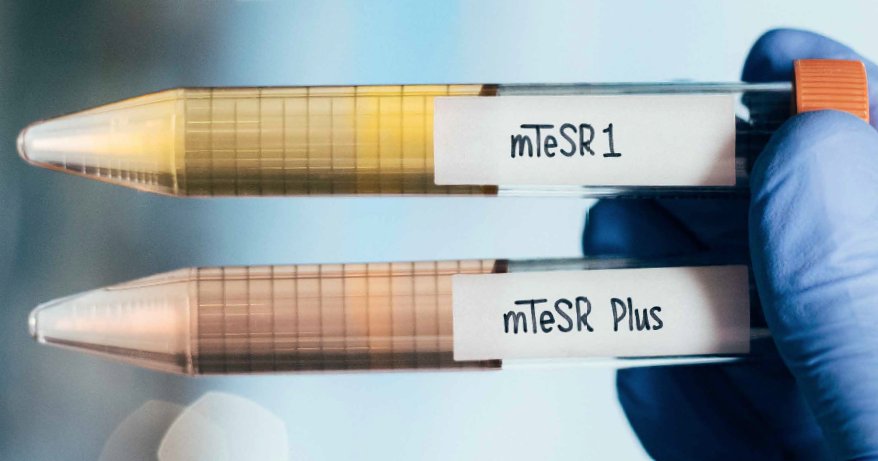
緩衝作用の改善により、細胞の品質をサポート
最近の研究により、培地のアシドーシスがDNA損傷のレベル、ゲノムの不安定性、およびヒトES/iPS細胞の増殖抑制と関連することがわかってきました。
mTeSR™ Plusにおける安定性の強化により、培地のpHが維持され、アシドーシスによる細胞への各種ダメージを軽減します。
72時間培養後も、培養に最適なpHレベルを維持
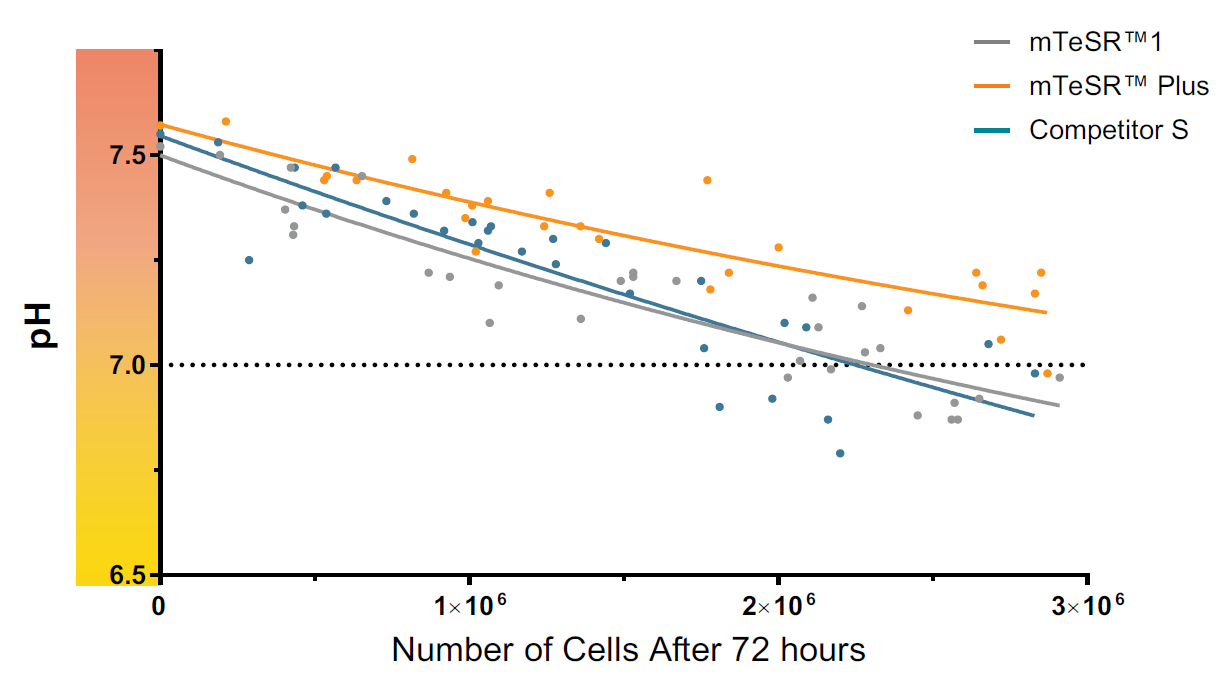
高品質な細胞② FGF2の安定化
mTeSR™ Plusはゴールドスタンダードである「mTeSR™1」※1の組成にもとづいた無血清培地ですが、4日間培地交換を完全フリーで培養可能です。緩衝作用(pH)の改善と、FGF2※2を含む培地の主要成分が安定化されており、細胞の品質維持をサポートします。
※1)mTeSR™1:世界50か国以上、1,500報以上の論文で使用実績がある世界No.1 のES/iPS細胞維持培地です
※2)FGF2(Fibroblast Growth Factor, 線維芽細胞成長因子):無血清の条件下で未分化なヒトES細胞を維持させる不可欠な成長因子として、2000年にMichal Amitらによって発見されました
37℃、72時間インキュベーション時の培地中FGF2の変化
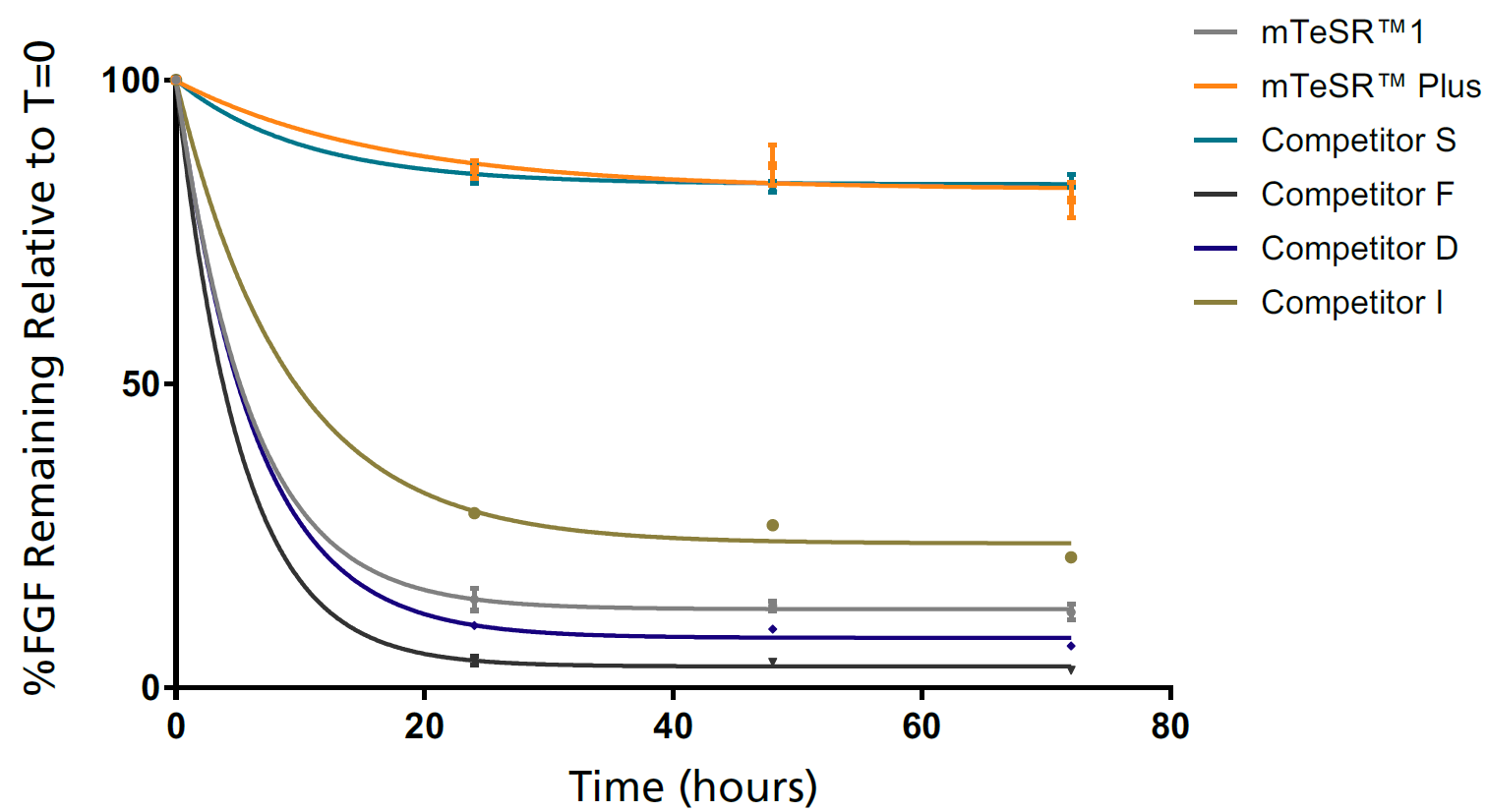
mTeSR™ Plusは、FGF2を安定なレベルで維持します。
(ELISA法による測定)
高品質な細胞③ 優れた形態と増殖能
mTeSR™ Plusで培養したES/iPS細胞は、高い細胞品質の証明となる、明確な辺縁を有する均一で密集したコロニーを形成します。
細胞は10回継代後も幹細胞の特徴である顕著な核小体および高い核対細胞質比(N/C)を保持しています。mTeSR™ Plusは、mTeSR™1の1.5倍以上の増殖能を有しています。
優れた増殖能
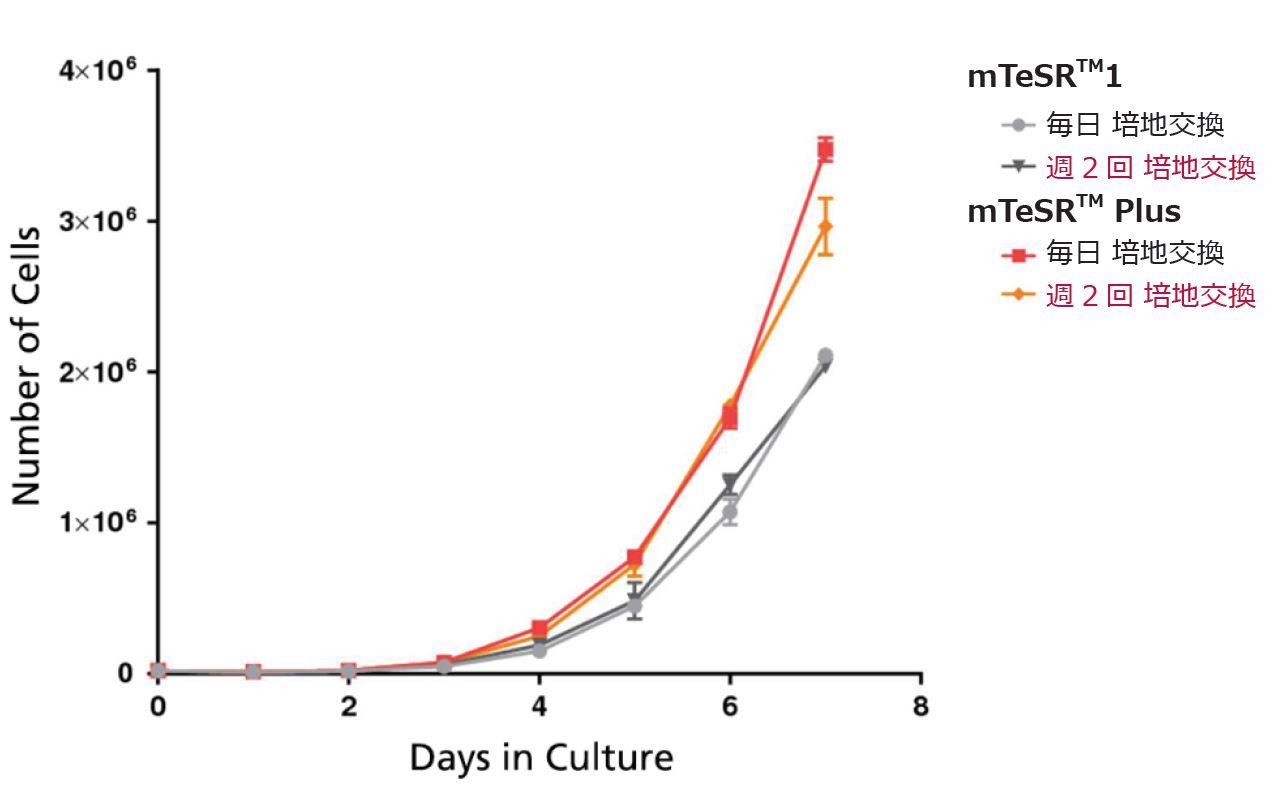
mTeSR™ Plusは、mTeSR™1の1.5倍以上の増殖能を示します。
コロニー形態の維持
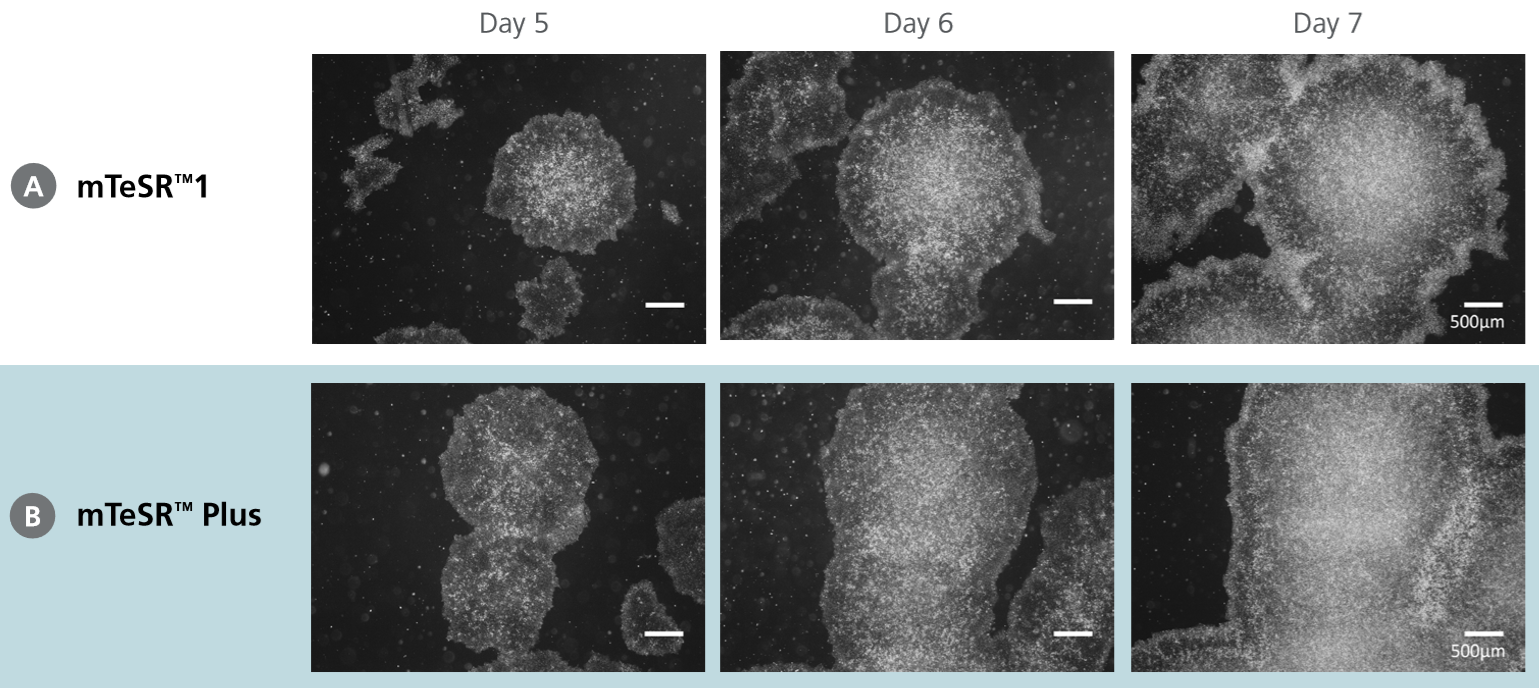
mTeSR™ Plusで週2回培地交換して培養したヒトES(H9)細胞は、従来のmTeSR™1で培養した細胞と比べて、より良い形態とより大きなコロニーを示します。
高品質な細胞④ 幹細胞の未分化性を維持
10~15回継代培養したヒトES細胞株(H1, H9)とヒトiPS細胞株(WLS-1C, STiPS-M001)は、未分化マーカーの発現を維持します。
ヒト多能性幹細胞の未分化マーカー発現
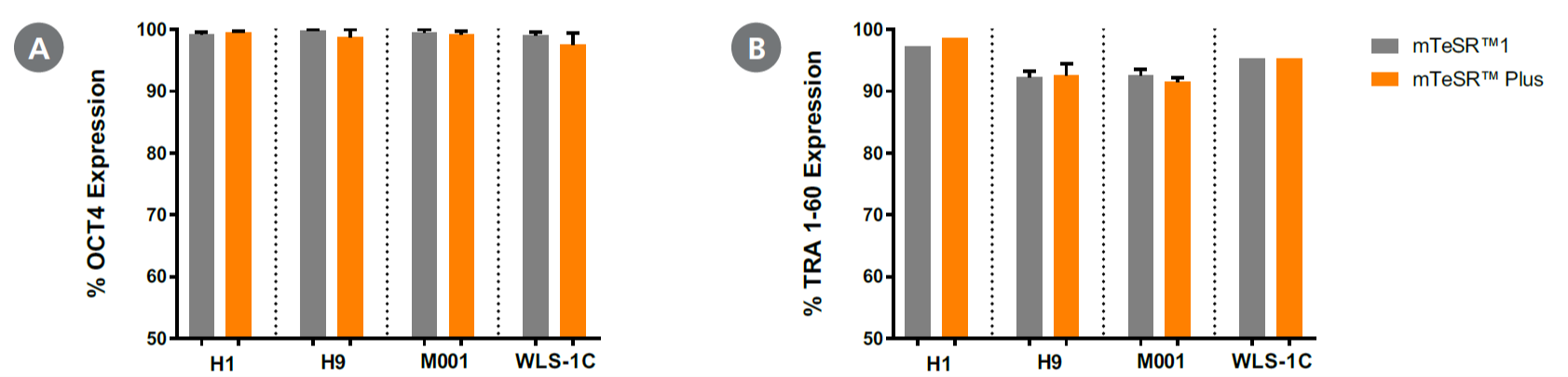
mTeSR™ Plus(週2回の培地交換)で維持培養したヒトES細胞株(H1, H9)とヒトiPS細胞株(WLS-1C, STiPS-M001)の未分化マーカーの発現を、フローサイトメトリーで解析しました。
(A) OCT3/4 と (B) TRA-1-60の発現の維持を確認できました。
高品質な細胞⑤ 3胚葉への多分化能を維持
mTeSR™ Plusで培養したiPS細胞(WLS-1C)は、3胚葉へ効率的に分化させられます。
ヒト多能性幹細胞の分化能評価
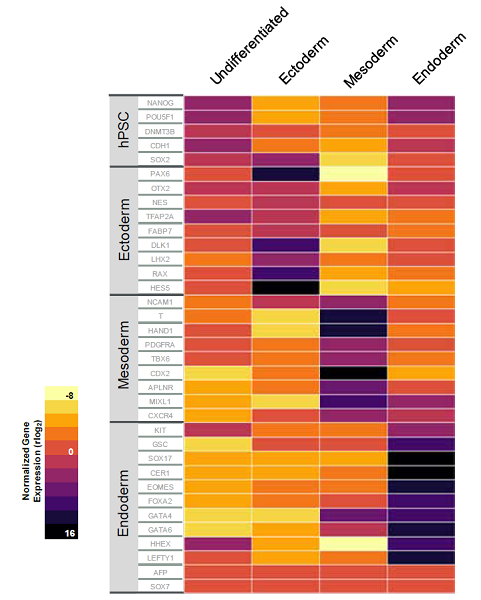
mTeSR™ Plus(週2回の培地交換)で維持培養したiPS細胞 (WLS-1C) を3胚葉へ分化させました。
3胚葉の主なマーカー発現のレベルをhPSC Trilineage Differentiation qPCR Arrayで解析したところ、各胚葉特異的マーカーの明確な発現上昇を確認しました。
3胚葉への多分化能評価について:
STEMCELL Technologies社のSTEMdiff™ Trilineage Differentiation Kitは、研究室で維持している細胞株や、新たに樹立した細胞株の3胚葉分化能を手軽に評価するためのキットで、品質管理を簡便に実施できます。従来のテラトーマアッセイやEB法に代わる、低コストで信頼性の高いアッセイとしてご利用ください。あるいは、本品をスクリーニングとして使用し、従来法で詳細な確認を行うことも可能です。
高品質な細胞⑥ ES/iPS細胞のクローニング効率の向上
CRISPR-Cas9の使いやすさと汎用性は、個々の遺伝子と遺伝的変異が生物学と病因にどのような影響を与えるかについて理解を深める上で極めて重要です。ES/iPS細胞と組み合わせて使用され、幹細胞研究に革命をもたらしました。
ES/iPS細胞のような複雑な細胞型にとって、ゲノム編集実験を成功させるために、ゲノム編集前後の培養は最適化すべき重要なステップです。
mTeSR™ PlusはSTEMCELL Technologies社のCRISPR-Cas9システムとシームレスに連携して効率的な編集を行い、CloneR™と組み合わせることで堅牢な培養システムを提供し、効果的に編集後の高い生存率をサポートします。
シングルセル生存率を改善するCloneR™の併用で、高効率にクローニング
mTeSR™ PlusはmTeSR™1以上に、CloneR™との併用でヒトES細胞(H1, H9)とヒトiPS細胞(WLS-1C, STiPS-M001)のクローニング効率向上を示します。
より早く、大きいコロニーを取得

mTeSR™1(A)で得られたクローンと比べて、mTeSR™ Plusで得られたクローン(B)はより大きく、より早い時点で選択することができます。
(画像は、シングルセルを25 cells/cm²で播種後して8日目の、ヒトES細胞(H9)の代表的なコロニー)
高品質な細胞⑦ 正常な核型を維持
ヒトES/iPS細胞は、ルーチンの培養中にノンランダムかつ散発的に核型異常を獲得する能力があります。これらの細胞遺伝学的変化の背後にあるメカニズムは未知です。再発性の異常がヒトの癌においても多くに観察されており、治療用途にこれらの細胞を使用することに対して安全性の懸念が議論されています。
mTeSR™ Plusはその培地の安定性により、遺伝子の安定性ももたらします。
ヒト多能性幹細胞の核型を正常に維持
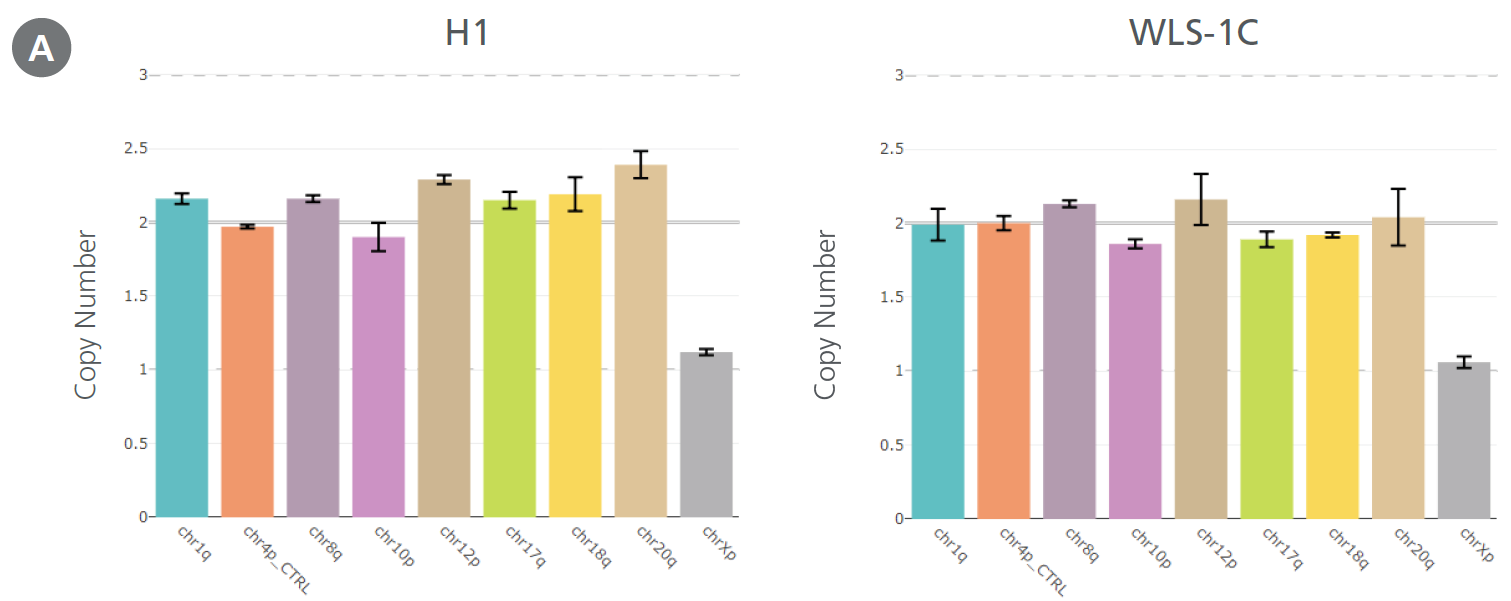
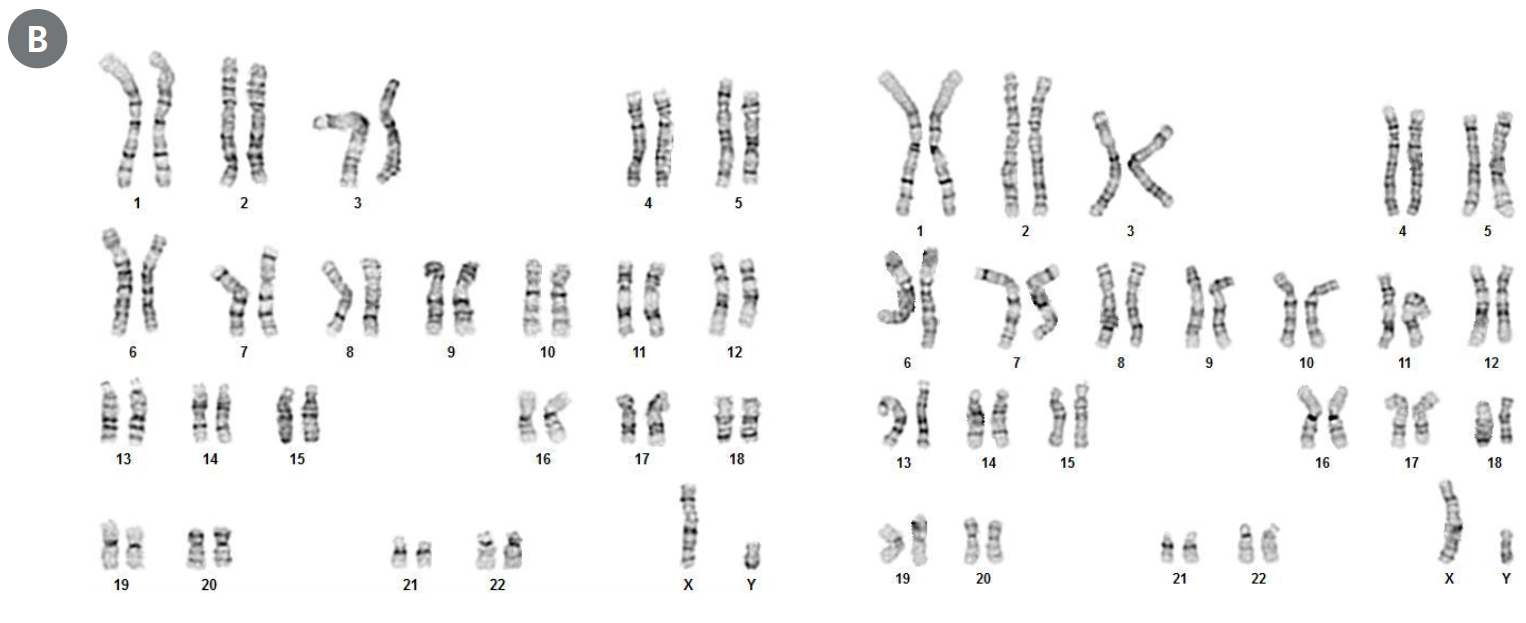
mTeSR™ Plusの培地交換週2回のプロトコルで培養した(左) ヒトES (H1)、(右) iPS (WLS-1C) 細胞では、12回継代しても遺伝子異常は検出されません。(A)hPSC Genetic Analysis Kit、および(B)Gバンド法での検出結果を示しています。
Gバンド法で検出困難な核型異常検出について:
ヒトES/iPS細胞において最も影響を受け易い染色体は、1、8、10、12、17、18、20、およびXと言われています。しかし、20qの変異は小さいため、Gバンド法で確認しにくい異常と言われています。以下の例のようなGバンドで確認できない遺伝子異常には、hPSC Genetic Analysis Kitをお試し下さい。ヒト多能性幹細胞(ES/iPS細胞)で報告されている8種類の核型異常を同時検出できるスクリーニング用qPCRキットです。
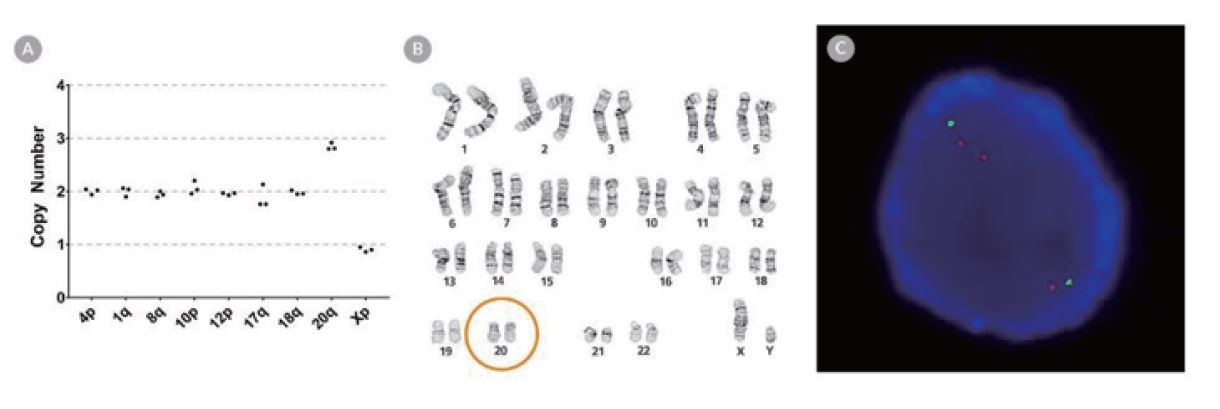
Gバンド法で重複の検出確認が出来なかった、20q11.21染色体重複の同定。
(A)hPSC Genetic Analysis KitでSTiPS-4D1 hiPS 細胞株の20q11.21染色体重複を検出しました。
(B)Gバンド法では染色体重複を検出できませんでした。
(C)20p11(緑)と20q11.21(赤)のプローブによる蛍光in situハイブリダイゼーションでも確認されました。