ラーニングコーナー
2018/02/26
「TeSR + CloneR」ヒト多能性幹細胞(hPSC)ゲノム編集のワークフロー
- 用途別細胞培養
自己複製能と多分化能を持っているヒト多能性幹細胞(ヒトES/iPS細胞、hPSC)は強力な研究ツールかつ疾患モデルとして、患者細胞由来の疾患表現型および遺伝子型の再現によく利用されています。ヒト多能性幹細胞およびゲノム編集(*ZFN、TALEN、CRISPR/Cas9)などの革新的な技術を組み合わせて、疾患モデルにおける遺伝的変異の機能的研究や広範な再生医療研究をおこなうことができます。
*ZFN (Zinc-Finger Nuclease)、TALEN (Transcription Activator-Like Effector Nuclease)、CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) /Cas9 (Crispr Associated protein 9)
「TeSR + CloneR」ゲノム編集のワークフロー
STEMCELL Technologies社のCloneR™は、ヒト多能性幹細胞ゲノム編集のシングルセルの生存率とクローニング効率(通常は1%以下、CloneRなら約20%以上)を改善します。
さらに「TeSR+CloneR」を組み合わせて、標準的なヒト多能性幹細胞のゲノム編集プロトコールを提供します。
「TeSR + CloneR」により、ゲノム編集後のヒト多能性幹細胞を馴化させることなく効率よくクローニングでき、ゲノム変異のリスクも最小限に抑えます。
「TeSR + CloneR」によるゲノム編集のワークフロー 概要
「TeSR + CloneR」ヒト多能性幹細胞(hPSC)のCRISPRゲノム編集
「TeSR + CloneR」を使うメリット
「TeSR + CloneR」でワークフローをシンプル化できます
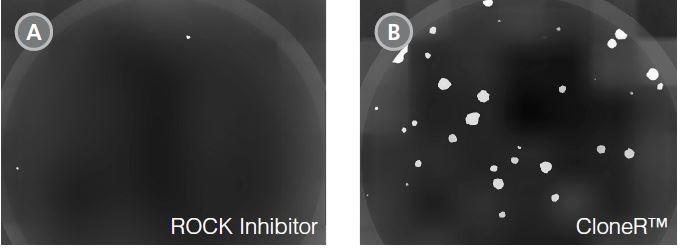
「TeSR + CloneR」はROCKi法に比べてクローニング効率を向上できます
mTeSR1にROCK inhibitor(10μM Y-27632)を加えた場合(A)に比べて、CloneRを加えた場合(B)のヒト多能性幹細胞のクローニング効率は顕著に高くなりました。
下図は12ウェルプレートにH1 ES細胞を播種し(100 cells/well, 25 cells/cm2)、7日目にコロニーをアルカリフォスファタ-ゼ染色した様子を示したものです。
マトリックスはVitronectin XFを使用しました。
「TeSR + CloneR」データ例
ヒト多能性幹細胞の形態
「TeSR + CloneR」で樹立したhPSCのコロニーは大きい
CloneRを添加したmTeSR1で培養した細胞(B)は、ROCK inhibitor(10μM Y-27632)を加えたmTeSR1で培養した細胞(A)に比べて大きなヒト多能性幹細胞のシングルコロニーを形成します。
いずれも播種後7日目の画像です。

ヒト多能性幹細胞の未分化性
「TeSR + CloneR」で樹立したhPSCは未分化マーカーを高く発現
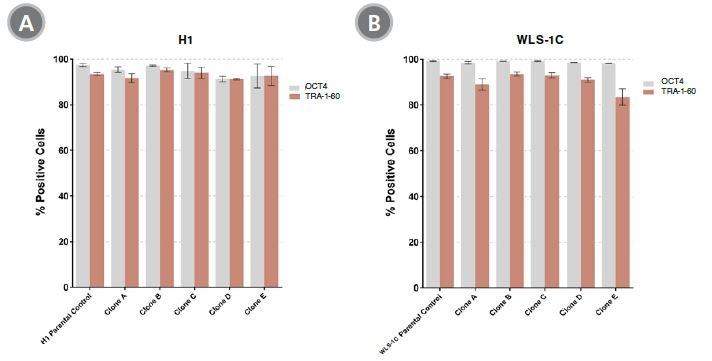
「TeSR + CloneR」で樹立したH1 hES細胞株(A)およびWLS-1C hiPS細胞株(B)の未分化マーカー(OCT4およびTRA-1-60)の発現を調べました。
どちらも親細胞株と比べて未分化マーカーの発現レベルが同等でした。
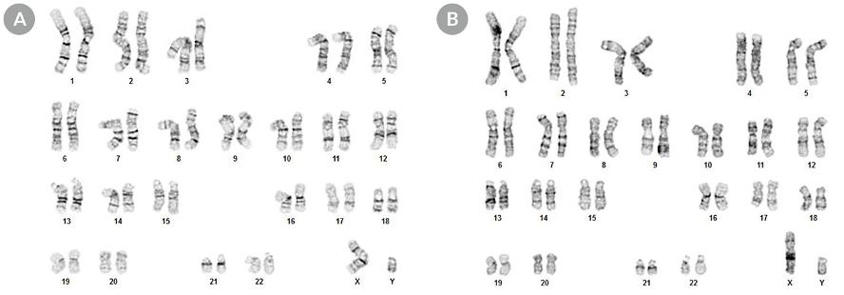
ヒト多能性幹細胞の核型
「TeSR + CloneR」で樹立したhPSCは正常な核型を維持
「TeSR + CloneR」で樹立したH1 ヒトES細胞株(A)、WLS-1C ヒトiPS細胞株(B)、クローンの代表的な核図と比べて正常的な核型を示しました。
いずれもクローニング後第5継代の核型分析像です。継代数はそれぞれ45継代および39継代です。