ラーニングコーナー
2026/02/02
「BrainPhys」脳の生理条件を再現!神経生理学研究用 無血清培地
- 用途別細胞培養
BrainPhys™ ~ 神経活動と科学の可能性が交わる培地 ~
正確な疾患モデリングや予測的な薬剤スクリーニングは、脳の生理的環境を密接に再現する神経細胞培養に依存しています。ヒト多能性幹細胞(hPSC)由来のニューロンを活用した疾患メカニズムの研究においても、げっ歯類ニューロンモデルを用いた前臨床研究においても、結果の信頼性と妥当性は、脳との生理学的関連性の高い環境を再現性をもって作り出す能力にかかっています。
ニューロンが機能するためには活動している必要がありますが、従来の培地は神経活動よりもニューロンの生存を優先します。より生理学的関連性の高い研究を行うには、培養中に神経活動と成熟の両方をサポートすることが不可欠であり、良好なバランスへの到達に最適化された培地がBrainPhys™です。
BrainPhys™は、培養ニューロンの活動と成熟の両方を抑制することなく促進します。BrainPhys™製品群は神経研究に最適なソリューションを提供し、神経培養ワークフローの各段階に適した製品をラインナップから選択できます。神経ワークフローのさらなる効率化・最適化のためにお役立てください。
注:本稿は、STEMCELL Technologies社ウェブサイト(BrainPhys™ Neuronal Culture Media Where Neuronal Activity Meets Scientific Potential)の内容に基づいており、一部改変を加えています。
Why Use BrainPhys ?
BrainPhys™ Neuronal Mediumは神経細胞用の基礎培地で、神経の活性と成熟を促進します。
神経培養の課題を克服しようと開発された培地組成(Bardy et al. PNAS, 2015)に基づくBrainPhys™は、中枢神経系(CNS)の細胞外環境を模倣することにより、in vitro におけるニューロンの生存だけでなく、シナプス活性などの神経機能をより良くサポートします。
BrainPhys™ は、ヒト多能性幹細胞(hPSC)由来ニューロンやCNS由来プライマリーニューロンを長期間培養できます。さらに、微小電極アレイ(MEA)測定や蛍光ライブイメージングなどの機能アッセイにそのまま使用できるため、培地変更により細胞にショックを与えることもありません。
- 脳の細胞外環境を再現した無血清培地
- 神経機能を改善し、シナプス活性の高いニューロンの比率が増加
- 培地を変更せずにそのまま機能アッセイが可能
- プライマリーニューロンまたは多能性幹細胞由来ニューロンの長期培養に最適
- 厳密な原料スクリーニングと品質管理により、ロット間で培養の変動を最小限に抑制
神経活動を適切に評価することの重要性
機能的な神経活動が見られる培養は、シナプス伝達、可塑性、神経ネットワーク形成などの重要なプロセスを示すことによって脳の複雑さを模倣します。これらの特徴は、薬物スクリーニング、疾患モデリング、再生医療などのアプリケーションで決定的な役割を果たします。
ニューロンが機能するためには活動している必要があります。そのような生理的条件を再現できなければ、神経機能の障害、シナプス活動の低下、発達の未熟さ、そして信頼性の低い実験結果につながりかねません。
BrainPhys™培地は、神経活動の維持に必要な生理学的関連性の高い環境を再現し、上記アプリケーションにおける、より正確かつ信頼性の高い研究成果を保証します。
ともに発火する細胞はつながり合う
When an axon of cell A is near enough to excite a cell B and repeatedly or persistently takes part in firing it, some growth process or metabolic change takes place in one or both cells such that A's efficiency, as one of the cells firing B, is increased.
細胞Aの軸索が細胞Bを興奮させるほど近く、発火に繰り返しまたは持続的に関与すると、一方または両方の細胞で何らかの成長過程または代謝変化が起こり、AはBをより効率よく発火させるようになる。
Hebb, D.O. (1949). The Organization of Behavior. New York: Wiley & Sons.
BrainPhysと他の神経培地の比較
プライマリーニューロンおよびヒト多能性幹細胞(hPSC)由来ニューロンの培養に用いられた従来の培地は、神経機能を促進するよりも細胞の生存をサポートするように設計されていました。これらの培地は大抵、浸透圧が低く、非生理的な濃度の塩分およびグルコースを含み、シナプス活性を抑制する神経活性成分を含む場合もあります。このような条件は、活動電位の生成やシナプス伝達などの重要な機能に障害を引き起こします。
これらの制約を一時的に解消するため、研究者は通常、培地を人工脳脊髄液(artificial cerebrospinal fluid; ACSF)に置換してデータを記録します。しかし、頻繁な培地交換はニューロンにストレスを与え、測定前に非生理的培地に長時間にわたって曝露する点は依然として課題です。神経活動は細胞のシグナル伝達、生存、形態、遺伝子発現、そして細胞内タンパク質・小器官の局在に直接影響を与えるため、ニューロンの成熟期を通じて生理的条件を維持することは、生体内の中枢神経系をよりよく反映する安定的なモデルを創出します。
BrainPhys™は、神経活動や成熟を抑制するのではなく促進し、より生理的な環境をもたらします。以下では、プライマリーおよびhPSC由来のニューロンを含むさまざまな神経モデル培養において、BrainPhys™を他の神経培地と比較した結果をご覧ください。
BrainPhys™による生理的条件の達成と、神経機能のサポート
表1. BrainPhys™と従来の神経培地(DMEM/F12、Neurobasal®)の比較
上段:培地特性(Properties of the medium)は、各項目が生理的条件を満たす場合にチェック印を付けています。
下段:神経機能(Neuronal function)は、各項目の神経活動が生理的レベルで見られる場合にチェック印を付けています。
引用元:Bardy et al. PNAS, 2015
ラット皮質ニューロンの神経活動を長期に維持【MEAでの解析例】
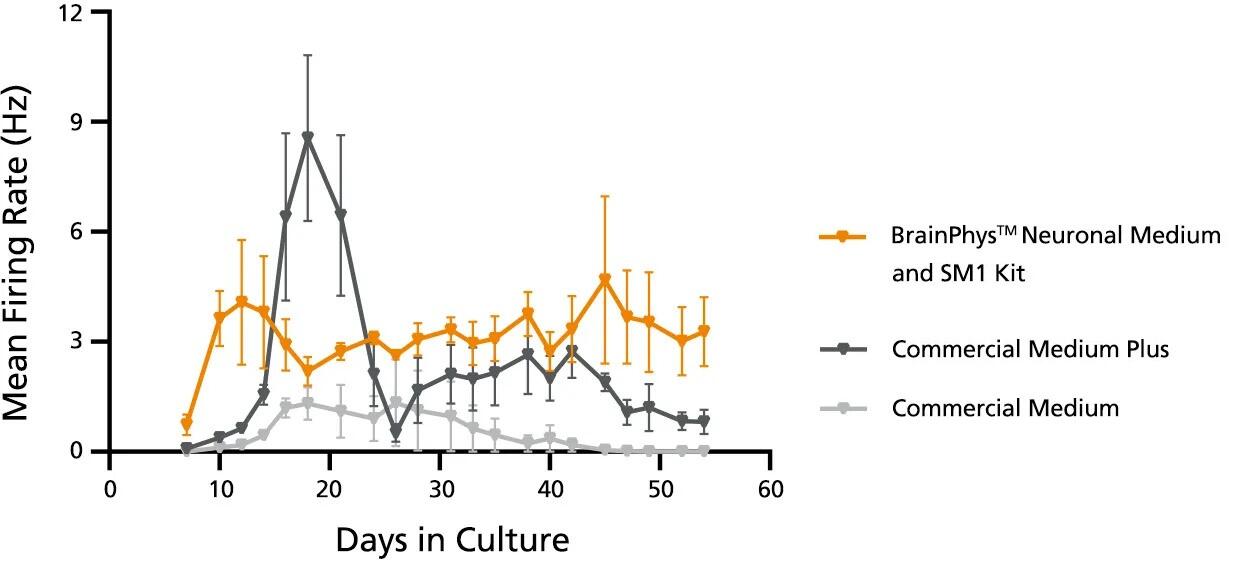
図1. グルコース添加したBrainPhys™は、他の市販培養系に比べて高い神経活性を維持
Primary E18 rat cortical neurons were cultured with BrainPhys™ and SM1 or other commercially available culture systems for 8 weeks. Neuronal activity can be detected at Day 9 with BrainPhys™, whereas activity is not detected until Day 14 in cultures maintained in either of the Commercial Media with Commercial Supplements. For Commercial Medium and Supplement-cultured neurons, mean firing rate remains low throughout culture. In contrast, a "peak-drop" activity pattern is observed in the Commercial Medium Plus condition, where mean firing rate increases rapidly within 2 days, followed by a drop in activity in the next 2 - 4 days. BrainPhys™and SM1 Kit with 15 mM glucose maintains the highest level of activity throughout the 8-week culture period.
*For applications that require particularly high seeding densities, such as MEA that results in greater-than-usual energetic demand, supplementation of BrainPhys™ with additional glucose (12.5 - 17.5 mM, e.g. final concentration of 15 - 20 mM) may be beneficial. We recommend optimizing for the lowest concentration that provides you with success in your application. The timing of supplementation should also be optimized. Cultures may be supplemented as soon as a culture is transitioned into BrainPhys™, but beginning the supplementation after 1-2 weeks in BrainPhys™ may also yield acceptable results.
ラット皮質ニューロンの化合物投与による神経活動変化を検出【MEAでの解析例】
図2. BrainPhys™は、他の市販培養系に比べて神経ネットワークの特徴をより良く検出
Individual wells of RCNs cultured in one of three media types (NeuroBasal + B27, BrainPhys + SM1, or NeuroBasal Plus + B27 Plus) are plotted according to their synchrony and activity metrics (A). Baseline and dosed values (1 hour after dosing with 4-AP) are shown for each media type (B) (n=4 wells for each media condition).
ラット皮質ニューロン(RCN)の神経活動を異なる培地中で測定し比較しました。BrainPhys™ + SM1(NeuroCult™ SM1 Neuronal Supplement)を使用した場合、ベースラインの神経活動は中程度で、興奮性化合物の4-AP投与後に活性と同期が増加することを検出できました。
図2は、Axion Biosystems社のウェブサイト(Best practices for in vitro neural assays on the Maestro MEA system)より許可を得て転載。詳しくはこちらをご覧ください。
hPSC由来ニューロンの自発的シナプス活動を改善【電気生理(電圧固定法)での解析例】
図3. BrainPhys™は、DMEM/F12に比べて高い神経活性をサポート
Neural progenitor cells (NPCs) were generated from H9 cells using STEMdiff™ Neural Induction Medium in an embryoid body-based protocol. Next, NPCs were cultured for 44 days in vitro in (A,C) BrainPhys™ Neuronal Medium, supplemented with 2% NeuroCult™ SM1 Supplement, 1% N2 Supplement-A, 20 ng/mL GDNF, 20 ng/mL BDNF, 1 mM db-cAMP, and 200 nM ascorbic acid to initiate neuronal differentiation, or (B,D) in DMEM/F-12 under the same supplementation conditions. (A,C) Neurons matured in BrainPhys™ Neuronal Medium showed spontaneous excitatory (AMPA-mediated; A) and inhibitory (GABA-mediated; C) synaptic events by voltage-clamp electrophysiology. The frequency and amplitude of spontaneous synaptic events are consistently greater in neuronal cultures matured in BrainPhys™ Neuronal Medium compared to neurons plated and matured in DMEM/F-12 (B,D). Traces are representative.
BrainPhysを利用できる実験系
神経細胞を市販または自家製の培地で培養するワークフローに、BrainPhys™はスムーズに組み込めます。他の市販培地からBrainPhys™への移行は容易で、より機能的な細胞の培養を可能にします。以下では、2次元(2D)または3次元(3D)培養での使用例を紹介します。
さらに詳しく知りたい方は、冊子「神経研究のための培養ガイドブック」もご参照ください:
2D培養
BrainPhys™に適切なサプリメント*を添加してカスタマイズした「BrainPhys™ベースの培地」は、神経細胞の分化、成熟、共培養、機能アッセイなどの幅広い用途に使用できます。あるいは、BrainPhys™を含有する「STEMdiff™成熟用キット」を用いて、ヒト多能性幹細胞(hPSC)由来の各種ニューロンを最適化された条件で成熟させることもできます。
* 長期の無血清培養下で細胞の健康を保つのに必要な血清代替サプリメント(NeuroCult™ SM1 Neuronal Supplement、N2 Supplement-A など)。BrainPhys™にサプリメント類が付属した各種キット品もございます。
| 実験系 | BrainPhys™の利用方法 |
|---|---|
| hPSC由来ニューロンの分化 | ⇒ BrainPhys™ベースの培地 または BrainPhys hPSC Neuron Kitで培養 |
| hPSC由来ニューロンの成熟 | ⇒ BrainPhys™含有のSTEMdiff™成熟用キット(前脳ニューロン、中脳ニューロン、運動ニューロン、感覚ニューロン)で培養 |
| hPSC由来グリアとの共培養 | ⇒ STEMdiff™キットで分化したグリア(アストロサイト、ミクログリア)を、BrainPhys™ベースの培地で共培養 |
| げっ歯類プライマリーニューロンの培養 | ⇒ BrainPhys™ Primary Neuron Kit または BrainPhys™ベースの培地で培養 |
| 各種ニューロン・グリアの長期培養、機能アッセイ(MEAなど) | ⇒ BrainPhys™ベースの培地で培養 |
| 体細胞からニューロンへのリプログラミング | ⇒ BrainPhys™ベースの培地で培養 |
| ニューロンのライブ蛍光イメージング(カルシウムイメージング、光遺伝学) | ⇒ BrainPhys™ Imaging Optimized Medium(光毒性・緑色チャネル自家蛍光を低減)で培養 |
| ホルモンシグナルの制御が必要な実験 | ⇒ BrainPhys™ Without Phenol Red(フェノールレッド不含)で培養 |
3D培養
BrainPhys™は、神経オルガノイドの電気活動記録などの短期的な3D神経アプリケーションに適しています。例として、hPSC由来の脊髄オルガノイドをMEAで解析した結果を示します(図4)。BrainPhys™はまた、神経オルガノイドの長期的な成熟にも使用できます。適切なサプリメントの添加や、培養条件の最適化が必要になることがあります。
図4. 脊髄オルガノイドをBrainPhys™ベースの培地で成熟させた際の電気生理的活性の増加
BrainPhys™ was incorporated into a standardized spinal cord organoid workflow (Catalog #100-1524) by transitioning organoids from STEMdiff™ Spinal Cord Differentiation Medium to BrainPhys™ supplemented with STEMdiff™ Neural Organoid Supplement A, with medium changes every 2 - 3 days. Spinal cord organoids matured in BrainPhys™ Neuronal Medium + STEMdiff™ Neural Organoid Supplement A displayed higher electrophysiological activity as measured by MEA compared to those matured in STEMdiff™ Neural Organoid Maintenance Kit Medium (Catalog #100-0120), with increased spikes, active electrodes, weighted mean firing rate (WMFR), burst number and frequency, and synchrony index. Data were normally distributed (D’Agostino & Pearson test) and analyzed with a paired t-test (n = 3 cell lines, 1 - 3 technical replicates; * p ≤ 0.05,** p ≤ 0.01).
図4は、学会発表ポスター(Figure 5C)より転載。詳しくはこちらをご覧ください。
毒性・薬剤応答性の研究に最適なBrainPhys
BrainPhys™は、神経細胞に対する薬剤の毒性や応答性の研究にも最適です。げっ歯類のプライマリーニューロンや、ヒト多能性幹細胞由来のニューロン・神経オルガノイドなどが対象となります。以下では、国内研究者によるMEAを用いたアプリケーション例を紹介します。
| 概要 | 詳細ページ |
|---|---|
|
ラット初代培養皮質神経細胞の神経活動及び薬物応答性に与える培地条件の検討 |
詳細を見る |
|
96ウェル 中脳オルガノイドの電気活動を指標とした化合物応答 |
詳細を見る |
|
大脳皮質オルガノイドにおける痙攣陽性化合物および抗てんかん薬の応答 |
詳細を見る |
その他のBrainPhysアプリケーション
神経細胞の2次元(2D)または3次元(3D)培養で、BrainPhys™を使用したアプリケーションや論文の一部を紹介します。
さらに詳しく知りたい方は、冊子「神経研究のための培養ガイドブック」もご参照ください:
2D培養
| 細胞タイプ | BrainPhys™を使用したアプリケーション |
|---|---|
| hPSC由来前脳ニューロン | ⇒ MEA プロトコル>> |
| hPSC由来前脳ニューロン、アストロサイト | ⇒ 共培養 プロトコル>> |
| hPSC由来アストロサイト、前脳ニューロン、ミクログリア | ⇒ オートファジーアッセイ、カルシウムイメージング、共培養 学会発表ポスター>> ⇒ 共培養 プロトコル>> |
| hPSC由来運動ニューロン、ミクログリア | ⇒ 共培養 プロトコル>> (詳しくはお問い合わせください) |
| げっ歯類プライマリーニューロン | ⇒ 毒性スクリーニング 学会発表ポスター>> ⇒ MEA プロトコル>> |
3D培養
| 細胞タイプ | BrainPhys™を使用したアプリケーション |
|---|---|
| hPSC由来脊髄オルガノイド | ⇒ 長期培養、MEA 学会発表ポスター>> |
| hPSC由来中脳・大脳・脊髄オルガノイド | ⇒ 長期培養、MEA 学会発表ポスター>> |
| hPSC由来前脳・大脳オルガノイド | ⇒ 長期培養、MEA 学会発表ポスター>> |
論文
- Proteolytic activities of extracellular vesicles attenuate A-synuclein aggregation K. Vekrellis et al. NPJ Parkinson's Disease 2025 Sep
- Lithium partially rescues gene expression and enhancer activity from heterozygous knockout of AKAP11 while inducing novel differential changes N. Farhangdoost et al. Scientific Reports 2025 Oct
- Rescue of imprinted genes by epigenome editing in human cellular models of Prader-Willi syndrome A. Nemoto et al. Nature Communications 2025 Oct
その他の論文は、こちら>>