ラーニングコーナー
2020/03/18
StemSpan™ Leukemic Cell Culture Kitを用いた薬剤のスクリーニング
- 用途別細胞培養
StemSpan™ Leukemic Cell Culture Kit を使用して、慢性骨髄性白血病 (chronic myeloid leukemia; CML)、または急性骨髄性白血病 (acute myeloid leukemia; AML) の患者から単離した造血幹細胞および前駆細胞 (hematopoietic stem and progenitor cell; HSPC) に対する、薬剤の効果を試験できます。本稿では、薬剤スクリーニングアッセイの方法と解析結果を紹介します。
本稿は、STEMCELL Technologies社ウェブサイト(https://www.stemcell.com/technical-resources/drug-screening-leukemic-cells-with-stemspan.html)の簡易訳です。
背景
癌の診断と治療の大きな進歩にもかかわらず、白血病の幹細胞や前駆細胞は現行の治療法に対して強い抵抗性を持つことが知られています。そのため、白血病幹細胞 (leukemic stem cell; LSC) を狙い打ちできる治療法を見つけることが白血病研究の主要な焦点となっています。
液体培養アッセイ系は、in vitroのコロニー形成ユニット (colony-forming unit; CFU) アッセイやin vivoの研究に先立って薬の効果をスクリーニングするために、最初の段階でよく使われます 1, 2。CMLやAMLの患者サンプル由来のプライマリ細胞(初代細胞)の培養は、細胞株よりもin vivoにおける白血病の複雑性をよく再現することが知られ、臨床展開した際の結果を予測する薬剤スクリーニングに適しています3,4。しかし、患者サンプルの不足により、前臨床的な薬剤スクリーニングアッセイに十分な量のプライマリ細胞の調達は制限される状況です。
本稿で紹介する薬剤スクリーニングアッセイのプロトコルは、CMLとAMLのCD34陽性細胞を増殖・維持する StemSpan™ Leukemic Cell Culture Kit (商品コード:ST-09720) を使用します。この液体培養ベースの細胞毒性アッセイは、少数のプライマリ細胞から開始することができ、LSCの除去に対する薬剤の有効性を評価できます。同プロトコルは、健康な骨髄 (bone marrow; BM) や臍帯血 (cord blood; CB) にも適用でき、候補となる薬剤の毒性や非特異性を健康な細胞と疾患細胞で比較可能です。さらに、個別化医療において、特定の患者サンプルに対する薬剤の有効性を試験する場合にも使用できる可能性があります。
なぜ薬剤スクリーニングにStemSpanTMを使用するのか?
StemSpan™ Leukemic Cell Culture Kit を使用した薬剤スクリーニングには、以下の利点があります。
- 高い特異性 CD34陽性白血病細胞を増殖および維持する培養条件
- フレキシブル フローサイトメトリーやプレートリーダーなど、異なる測定法で細胞増殖の変化を読み取り可能
- 簡単 CFUアッセイと比べて、結果読み取りまでの時間が短く(7日未満)、方法がシンプル
- 検証済み CFUアッセイ*で決定される50%抑制濃度(IC50)値と近い値を取得
*CFUアッセイは、in vitroの血液毒性アッセイにおいて現行の標準法となっています。
In Vitro 薬剤スクリーニングアッセイ法
StemSpan™ Leukemic Cell Culture Kit を用いた96ウェルフォーマットの薬剤スクリーニングアッセイでは、定量的、安定的、かつハイスループットに結果を得られます。加えて、アッセイで得られる結果は、細胞系列特異的な HemaTox™アッセイ (ST-09704) と同様、CFUアッセイの結果と相関があります³。従来、CFUアッセイが薬剤の有効性や細胞毒性の測定に用いられてきましたが、この液体培養ベースのアッセイは所要時間がより短く、扱い易く、柔軟性があります。そのため、long-term culture-initiating cell (LTC-IC) アッセイや前臨床のマウスモデルなど高コストなアッセイへ移行する前に、薬剤候補のリストを早く確実に絞り込めるようになります。
CD34陽性のCMLまたはAML細胞は、増殖していない細胞・増殖した細胞のどちらも、白血病細胞の成長と増殖に対する試験化合物の影響を評価する薬剤スクリーニングに使用できます。
薬剤スクリーニングアッセイの解析には、自動セルカウント、プレートリーダーによるセルカウント、またはフローサイトメーターによる標識細胞 (7-AAD陰性、CD45陽性、CD34陽性細胞など) の絶対細胞数カウントなどの方法を使用します。

Figure 1. 一般的な細胞毒性アッセイの流れ
EasySep™ Human Cord Blood CD34 Positive Selection Kit II (ST-17896)で、CMLまたはAML患者由来の末梢血単核細胞 (PBMC) または骨髄単核細胞 (BMMC) からCD34陽性細胞を単離します。細胞は必要に応じて StemSpan™ Leukemic Cell Culture Kitで7〜14日間増殖させます。増殖していない細胞、または増殖した細胞を96ウェルプレート、StemSpan™ Leukemic Cell Culture Medium(試験化合物またはコントロールを添加)中で37℃、7日間培養し、フローサイトメトリーやその他の解析を行いIC50値を決定します。
- 製品情報資料の記載に従ってStemSpan™ Leukemic Cell Culture Mediumを調製します。
- 試験化合物を適切な溶媒で希釈し、培養試験する濃度の少なくとも 1000 倍 (1000X)にします。これが試験化合物ストック溶液(test compound stock solution)です。
- ステップ2で調製したストック溶液をStemSpan™Leukemic Cell Culture Mediumで希釈して2X test compound solutionを調製します。
- 溶媒コントロールを作製するため、コントロール溶媒をStemSpan™ Leukemic Cell Culture Mediumで希釈し、2X test compound solution中の同溶媒と同濃度に調製します。
- 製品情報資料の記載に従って、CD34陽性のCMLおよびAML細胞(増殖していない細胞、または増殖した細胞)を調製します。
- プレーティング直前に、細胞濃度が1000 - 8000 viable CD34+ CMLまたはAML cells/100 μL (10,000 - 80,000 cells/mL)となるようにStemSpan™ Leukemic Cell Culture Mediumで希釈します。
- ステップ6で調製した細胞懸濁液100 μLを、平底96ウェルプレートの各ウェルに添加します。
- 2X test compound solution または溶媒コントロール100 μLを各ウェルに添加し、穏やかにピペッティングして混合します。
- スクエア皿 (ST-38039など) に96ウェルプレートを置き、その周囲に滅菌水を満たした4 x 35 mm ディッシュ(ST-27100など)を置いて囲みます。
- 37℃、5% CO2 、湿度> 95%で7日間インキュベートします。
- フローサイトメトリーで表現型タイピングを行うため、細胞を複数の表面マーカー(HSPCマーカーのCD34やCD45など)で標識します。染色はALDEFLUOR™アッセイと並行して行うこともできます。細胞標識の詳細についてはこちらを参照してください。
- フローサイトメトリーで解析します。
解析結果例
CD34陽性のCMLまたはAML細胞増殖に対する試験化合物の効果測定には、適切な読み取り方法を選ぶことができます。推奨される方法には、培養細胞を細胞系列特異的な細胞表面マーカーに対して染色し、それらのマーカー分子を発現する細胞の絶対数をフローサイトメーターでカウントする手法があります。これによりアッセイでの各試験化合物への応答を定量化し、50%および90%抑制濃度(IC50およびIC90)を見積もることが可能となります。
他の読み取り方法 (自動セルカウント、イメージングサイトメトリー、プレートリーダーベースの手法など)も使用できますが、条件の最適化が必要になる場合があります。
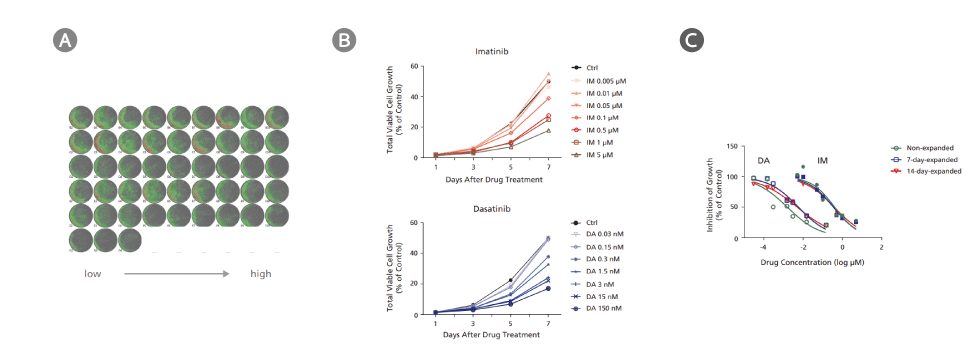
Figure 2. CML細胞にStemSpan™ Leukemic Cell Culture Mediumを使用した薬剤スクリーニングアッセイ
CD34陽性のCML細胞をStemSpan™ Leukemic Cell Culture Medium中でイマチニブ(imatinib; IM)とダサチニブ(dasatinib; DA)により7日間処理しました。細胞は増殖をモニタリングするために、2日に1回高解像度のイメージングシステムで画像化し、フローサイトメトリーでIC50を測定するため7日後に回収しました。(A) IMおよびDA処理後7日目の代表的な細胞画像(増殖していない細胞)。IMおよびDA処理を低〜高濃度で、サンプルはn=3で行った結果を示しています。緑(低密度)と赤(高密度)の細胞群が見られます。 (B) IMおよびDA処理した場合の代表的な成長曲線(増殖していない細胞)。成長曲線はイメージングシステムで2日に1回撮られた細胞画像と、その細胞密度アルゴリズムにより作成しました。(C) 増殖していない細胞、7日間増殖した細胞、14日間増殖した細胞の用量応答曲線。曲線は薬剤処理7日後のフローサイトメトリー解析による7-AAD陰性細胞に基づき作成しました。各薬剤濃度における細胞数は、溶媒コントロールの細胞数を基準として標準化しました(コントロールに対する%)。
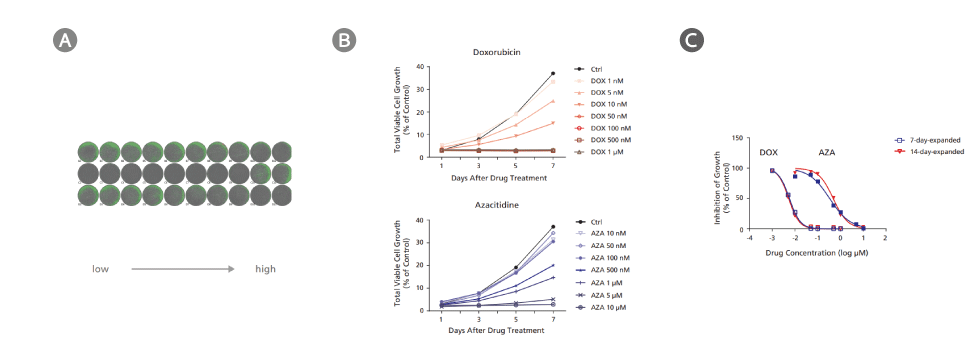
Figure 3. AML細胞にStemSpan™ Leukemic Cell Culture Mediumを使用した薬剤スクリーニングアッセイ
CD34陽性のAML細胞をStemSpan™ Leukemic Cell Culture Medium中でドクソルビチン(doxorubicin; DOX)とアザシチジン(azacitidine; AZA)により7日間処理しました。細胞は増殖をモニタリングするために、2日に1回高解像度のイメージングシステムで画像化し、フローサイトメトリーでIC50を測定するため7日後に回収しました。(A) DOXおよびAZA処理後7日目の代表的な細胞画像(7日間増殖した細胞)。DOXおよびAZA処理を低〜高濃度で、サンプルはn=2で行った結果を示しています。緑(低密度)と赤(高密度)の細胞群が見られます。(B) DOXおよびAZA処理した場合の代表的な成長曲線(7日間増殖した細胞)。成長曲線はイメージングシステムで2日に1回撮られた細胞画像と、その細胞密度アルゴリズムにより作成しました。(C)7日間増殖した細胞と、14日間増殖した細胞の用量応答曲線。曲線は薬剤処理7日後のフローサイトメトリー解析による7-AAD陰性細胞に基づき作成しました。
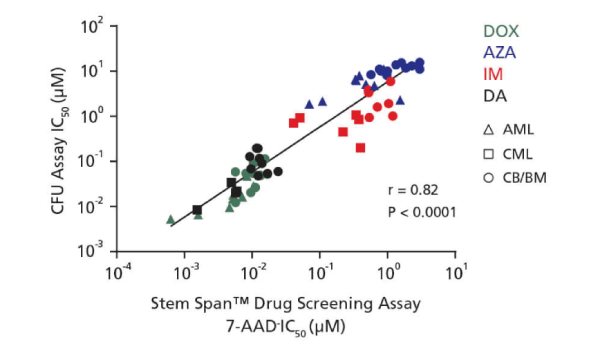
Figure 4. CFUアッセイと96ウェル液体培養アッセイから得られたIC50値の相関
CML、AML、臍帯血(CB)のCD34陽性細胞(増殖していない、または増殖した細胞)について、MethoCult™ H4435 Enriched mediumを用いたCFUアッセイ培養と、4種の薬剤(DOX (緑), AZA (青), IM (赤), DA (黒))存在下でのStemSpan™ Leukemic Cell Culture Mediumによる液体培養を行ないました。AML細胞にはDOXおよびAZA処理、CML細胞にはIMおよびDA処理、CB細胞にはDOX、AZA、IM、DA処理を行ないました。
参考文献
- Lai D et al. (2018) PP2A inhibition sensitizes cancer stem cells to ABL tyrosine kinase inhibitors in BCR-ABL+ human leukemia. Science Translational Medicine 10(427).
- Minzel W et al. (2018) Small molecules co-targeting CKIα and the transcriptional kinases CDK7/9 control AML in preclinical models. Cell 175(1): 171-185.
- Uppal H et al. (2015) Potential mechanisms for thrombocytopenia development with trastuzumab emtansine (T-DM1). Clinical Cancer Research 21(1): 123–133.
- Xing et al. (2012) Selective small molecule inhibitors of p110α and δ isoforms of phosphoinosityl-3-kinase are cytotoxic to human acute myeloid leukemia progenitors. Experimental Hematology 40(11): 922-933.
- Fares I et al. (2014) Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science 345(6203): 1509–1512.