ラーニングコーナー
2022/01/18
よくある質問 ~マウス腸オルガノイドの培養~
- 用途別細胞培養
IntestiCult™ Organoid Growth Medium (OGM) (Mouse)(商品コード:ST-06005)をもちいてマウス腸オルガノイドを培養する際に、よくある質問とその回答をまとめました。関連する技術資料もあわせてご紹介しています。
本稿の内容は、STEMCELL Technologies社ウェブサイトの記事 Frequently Asked Questions on Mouse Intestinal Organoid Cultureに基づいております。
試薬・器材のよくある質問
試薬・器材についてよくいただく質問にお答えします。
質問をクリックしていただくと回答が表示されます。
質問をクリックしていただくと回答が表示されます。
IntestiCult™ OGM (Mouse) の完全培地には、プロトコールのどこかで抗生物質を添加する必要がありますか?
はい、オルガノイドは微生物叢で覆われた腸から単離したクリプト(陰窩)より生成されますので、抗生物質を添加する必要があります。抗生物質の添加によって、細菌混入を最小限に抑えられます。 培地を使用する直前に抗生物質を加えることを推奨しています。培養プレート底面への接着を防ぐため、組織培養処理(TC treated)プレートの代わりに非組織培養処理(non TC treated)プレートを使用したほうが良いですか?
ドームの広がりが良くなるため、組織培養処理(TC treated)プレートを推奨しています。この場合、ドームがより広がります。非組織培養処理(non TC treated)プレートでは、ドームはよりコンパクトで高さが出るため、培地を交換する際にドーム頂上でせん断されるリスクが高まります。
初代腸オルガノイドの単離には、マウスの性別は重要ですか?
STEMCELL Technologies社では標準化のために、マウスはC57BL6系統で8週齢のオスを使用していますが、必要に応じてメスを使用することも可能です。ウシ血清アルブミン(BSA)の由来は問題になりますか?
いいえ、BSAは由来にかかわらず使用できます。培養でよくある質問
培養についてよくいただく質問にお答えします。
質問をクリックしていただくと回答が表示されます。
質問をクリックしていただくと回答が表示されます。
IntestiCult™ OGM (Mouse) の解凍を、室温(15 - 25°C)ではなく37°C のウォーターバスで行うことは可能ですか?
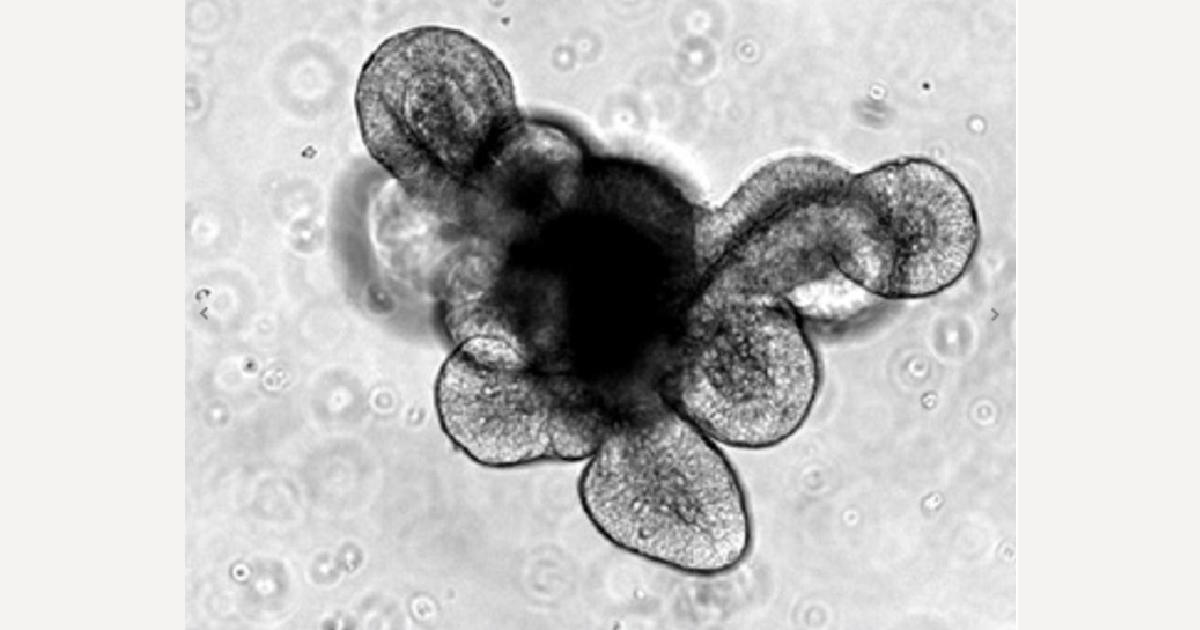
分注したIntestiCult™ OGM (Mouse) は、使用前に37°C のウォーターバスで解凍できます。しかし、この方法で解凍した培地の再凍結はおすすめしません。マウス小腸から成長したオルガノイドの培養の成功を示す、最も良い指標は何ですか?
形態が重要な決定因子で、多数の出芽と暗い内腔が見られる必要があります。しかし、内腔が暗くなるほど多くの細胞死と有毒環境の生成が起こっていることも意味しており、これは芽の劣化を引き起こす可能性があります。そのため、内腔が暗くなり過ぎる前にオルガノイドを継代してください。
マウス結腸由来のオルガノイドは小腸由来のものとは形態が異なり、出芽構造が少ない点にご注意ください
断片の大きさが異なると、成長の速さは異なりますか?
次のように算出します。Growth % = (Day 5 mature organoids counts)/ (Day 1 total counts)*100
例えば、培養1日目に20個の断片をカウントし、そのうち12個が5日目までに成熟オルガノイド※へ成長した場合は以下のようになります。
Growth % = 12/20 = 60 %
※ 成熟オルガノイドとは、2個以上の芽があるオルガノイドです。
ドームのための培地を交換する際に、IntestiCult™ OGM (Mouse)を予め温めておいてもよいですか?
はい、また室温の培地でも構いません。マトリゲル(Matrigel®)はドーム状にする必要がありますか、もしくはウェル全体に平らに敷き詰めることは可能ですか?
オルガノイドはプレートの底に沈むのを避けるため、ドーム内に播種する必要があります。オルガノイドがプラスチックに接触すると、分化して死滅する傾向があります。また、培地中の栄養は、平坦なマトリックスよりもドーム状構造の中心部に届きやすくなります。
オルガノイド培養のために最も理想的な小腸の部位はどこですか?
オルガノイド培養に最も適した部位は小腸の最初の約10 cmですが、小腸全体を使用することも可能です。【関連情報】
継代・維持に関してよくある質問
細胞の継代や維持に関してよくいただく質問にお答えします。
質問をクリックしていただくと回答が表示されます。
質問をクリックしていただくと回答が表示されます。
継代のために最適なドーム内のオルガノイド密度はどのくらいですか?もしドーム内のオルガノイドが多すぎたら、成熟する前に早めに継代することは可能ですか?
50 μlのMatrigel®ドームあたり、オルガノイドの最適な播種密度は約150個です。ドーム内が過密になった場合は、早めにオルガノイドを継代してください。継代後、オルガノイドは回復します。Gentle Cell Dissociation Reagent (GCDR) を冷やしてまたは温めて使用することは、継代プロトコールにどのように影響しますか?
GCDRを冷却すると、Matrigel®がより溶けやすくなります。ただし、このプロトコールではピペッティングによる機械的操作でMatrigel®を溶解するため、GCDRは室温で使用しても問題ありません。培養中に多くのデブリや細胞死が見られる場合、オルガノイドを早めに継代しても良いですか?
継代はデブリの量に関係なく、オルガノイドが成熟したタイミングで行ってください。成熟の目安は、暗い内腔と複数の芽の形成です。デブリが多い場合は、継代時に洗浄工程を追加することをご検討ください。
継代時に複数のドームを1本のチューブにまとめられますか?また、何個まで可能ですか?(技術報告Section 3のStep 8参照)
はい、スケールアップできます。まとめられるドームの個数に制限はありません。一般的には、15 mlチューブ1本に最大8個のドームをまとめます。
腸オルガノイドとGentle Cell Dissociation Reagent (GCDR) をインキュベートするための振盪器がない場合はどうすればよいですか?(技術報告Section 3のStep 9参照)
液の流れを起こすため、オービタルシェーカーまたは手でゆすってください。この工程の間、オルガノイドがチューブの底に沈まないようにします。
Gentle Cell Dissociation Reagent (GCDR) を使わず機械的にオルガノイドを継代できますか?
はい、ハイスループットのロボットシステムによって行うことができます。GCDRを使用しない機械的な破砕も可能ですが、GCDRを用いた場合に比べて効果は劣ります。これは、GCDRを使用することで断片のサイズをより均一に保てるためです。
なぜ継代時の分割比は、P1(解凍後の継代)で1:1なのに対し、P2では1:6なのですか?
解凍後のオルガノイド1バイアルは、まず4つのドームに分割します(P0)。この段階は『回復期』とされ、オルガノイドの増殖には適していません。次に、これらのウェルを分割比1:1で継代し、成長期に入ります(P1)。その後、増殖を促すために、分割比1:4または1:6で継代します(P2)。6個のドームを準備する際は、十分な量の培地とMatrigel®を加え、ピペッティングでよく混合することをおすすめします。
【関連動画】
動画で学ぶ 細胞培養(オルガノイドの培養)
腸管オルガノイド培養 (マウス) のプロトコール全体にわたる実演講義や段階的な手順
動画の視聴には、STEMCELL Technologies社ホームページでの登録が必要です。
腸管オルガノイド培養 (マウス) のプロトコール全体にわたる実演講義や段階的な手順
動画の視聴には、STEMCELL Technologies社ホームページでの登録が必要です。
凍結保存のよくある質問
凍結保存に関してよくいただく質問にお答えします。
質問をクリックしていただくと回答が表示されます。
質問をクリックしていただくと回答が表示されます。
Day 6またはオルガノイド1個当たり複数の芽が出たときに凍結保存することが推奨されています。必要であれば、継代の2-3日後に凍結保存することも可能ですか?
はい、オルガノイドの凍結保存は、ある程度の期間内で可能です。Day 6には各オルガノイドの出芽が最大となり、芽に含まれるLGR5+幹細胞やパネート細胞が新しいオルガノイドへと発達します。
明確なLGR5+幹細胞成分が確認できる場合、Day 2〜3で凍結保存することも可能ですが、再成長の効率は低下します。
オルガノイドをそのままの構造で凍結保存できますか?もしできる場合、推奨されるサイズはどのくらいですか?
オルガノイドを全体構造で凍結保存することは、推奨されません。解凍する際に全体構造が壊れて断片は死に、LGR5+幹細胞の成分が失われてしまうでしょう。